IT-Prozesse im regulierten Umfeld
Die behördlichen Anforderungen sind in der pharmazeutischen Industrie auch im Bereich der SAP Validierung enorm angestiegen, denn SAP ist inzwischen auch in der cGxP-pflichtigen Industrie weit verbreitet.
Doch was bedeutet “Validierung”? Die FDA sagt hierzu:
“Establishing documented evidence which provides a high degree of assurance that a specific process will consistently produce a product meeting its predetermined specifications and quality attributes.“
D.h. Validierung ist der dokumentierte Beweis, daß etwas das tut, was man von ihm erwartet. Validierung ist mithin ein integraler Bestandteil jedes QM-Systems.
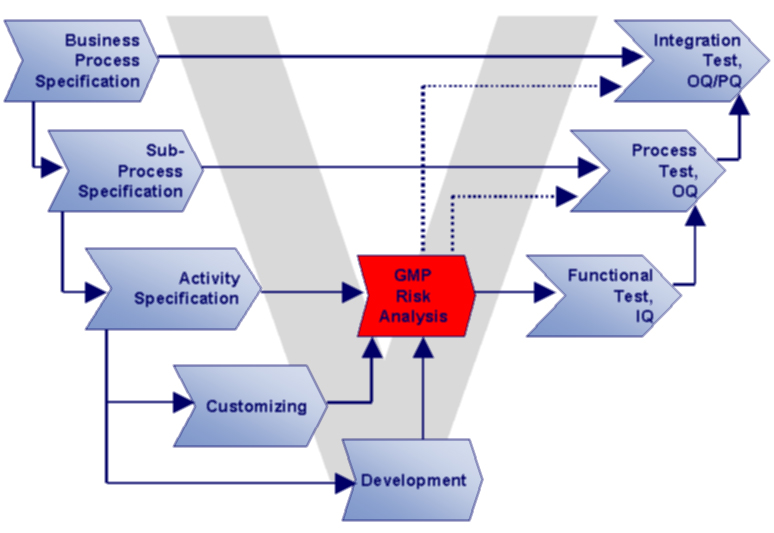
Oftmals führt die unterschiedliche Spezialisierung von Validierungs- und IT-Experten zu mehrfachem Dokumentationsaufwand bei redundanten Inhalten. Daher ist projektbegleitende Validierung deutlich effizienter als retrospektive Validierung. Durch eine sinnvolle Dokumentations- und Teststruktur entsprechend dem “V-Modell” nach GAMP können diese Anforderungen zusammengeführt werden.
Obwohl Validierung oft als lästige Pflicht angesehen wird, kann sie, richtig geplant und durchgeführt, durchaus einen wertvollen Nutzen erbringen:
- besseres Prozeßverständnis durch detaillierte Planung
- geringeres Risiko für Abweichungen und Fehler
- Fehler werden früher entdeckt
- besser geplanter Entwicklungsprozeß
- zusätzliche Projektkontrolle ohne Erfolgsdruck durch die Unabhängigkeit der Validierung
- Konformität mit den Regularien
- systematische Annäherung an Probleme anstelle von “Ad-hoc-Customizing“ bzw. “-programmierung“
- detaillierte Dokumentation von internem und externem Know-how